ISOMER
STRUKTUR SENYAWA HIDROKARBON DAN SISTEM NOMENKLATUR
A. Sistem Numenklatur
Tahun 1800, pada waktu kimia organik
baru muncul sebagai suatu ilmu,sruktur dari hampir semua senyawa yang baru
ditemukan belum diketahui. Untuk mengidentifikasinya senyawa tersebut harus
deberi nam terlebih dahulu. Para ahli member nama umumnya memilih nama untuk
menekankan sifat-sifatnya. Misalnya nama senyawa yang mudah terbakar, etana (CH3CH3),
berasal dari kata yunani “aithein” yang berarti menyala.
Tipe-tipe nama-nama ini disebut nama
trivial atau nama umum. menggunakan nama trivial ini memiliki sedikit ksukaran
yaitu karena umumnya dari namanya saja sehingga kita tidak dapat menembak rumus
senyawanya dan kemungkinan dua senyawa yang berlainan dengan tak sengaja akan
diberikan nama yang sama. Untuk menghindari hal tersebut, para ahli membuat
suatu peraturan untuk nomenklatur kimia organik. Ahli-ahli kimia ini membuat
suatu system yang menghubungkan struktur senyawa dengan namanya. System yang
dikembangkan ini disebut system numenklatur IUPAC, diambil dari international
union of pure and applied chemistry, suatu perkumpulan yang memperbaiki system
ini secara berkala.
a.
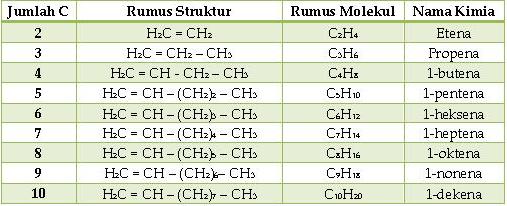
Alkana
Rantai Lurus
Nama
alkana rantai lurus menjadi dasar dari system numenklatur IUPAC. Nama sistematik dari empat alkana rantai
lurus prtama didasarkan pada nama-nama trivial dari senyawa-senyawa ini. Nama-nama
kelima dari alkana menggunakan bahasa yunani dan latin, misalnya penta yang
berarti lima. Akhiran ana dipakai untuk
semua alkan dan siloalkana untuk menunjukkan suatu hidrokarbon jenuh.

b.
Alkana
Rantai Cabang
Untuk
memberi nama suatu hidrokarbon yang memilii ranti cabang, kita harus menganggap
rantai lurus yang terpanjang sebagai induk dari namanya.


Nama dri alkana rantai
cabang dibut dengan menambahkan nama dari rantai cabangnya kepada rantai induk.
Rantai cabang seperti CH3 disebut gugus alkil. Nama masing-masing
gugus alkil berasal/diturunkan dari alkana yang akhirannya diganti il. Misalnya
metana diubah menjadi metal, begitu pula seterusnya.
Berikut
peraturan pemberian nama alkna ranti cabang yang sederhana :
1.
Tentukan
karbon rantai lurus terpnjang dalam rumus. Ini akan menjadi rantai induk dan
namanya akan menjadi nama utama dari senyawa tersebut.
2.
Beri
nomor karbon dari rantai induk, dimulai dengan karbon paling akhir yang
terdekat pada rantai cabang atau rantai tambahan
3.
Beri
nama rantai tambahan
4.
Satukan
namanya dengan member nomor tempat (nomor karbon dengan rantai cabang) dengan
tanda kitip dan nama rantai cabang serta induk menjadi sau kata.
Beberapa gugus fungsi
diberi nama juga sebagai awalan dalam system nomenklatur IUPAC. Seperti
c.
Gugus
Alkil Cabang
Rantai
cabang yang melekat pada rantai induk dapat berupa ranti lurus atau rantai
bercabang. Misalnya gugus alkil dengn 3 atom karbon, gugus propil. Suatu gugus
propil dapat terikat pada rantai induk pada atom karbon terakhir atau karbon
atom di tengah. Apabila gugus tiga atom tersebut terikat pada rantai lurus
induk pada karbon terakhir, maka gugus ppropil tersebut merupakan rantai lurus
yang namanya gugus propil.
Gugus alkil
tiga karbon rantai lurus

Apabila
ketiga atom dari propil melekat pada rantai induk di tengahnya maka gugus ini
akan bercabang. Gugus alkil ini dinamakan isopropil (berarti gugus ini beriomer
dengan gugus n-propil). Awalan iso harus dipakai.
Nama gugus
alkil cabng dimasukan dalam nma lkana seperti juga nama –nama gugus alkil lain.
d.
Substitusi
berganda
Apabila
suatu rantai induk memiliki lebih dari satu substitusi, nma dari substitusi
masing-masing dengan temptnya ditulis secara abjad dimuka nama senyawanya. Pada
nama ini, tiap awalan dipisahkan dari nomor tempat oleh suatu tanda penghubung
(-) dan awalan yang berlainan juga dipisahkan oleh tand penghubung seperti
terlihat dalam contoh berikut:

Apabila
sebuah rantai induk mengandung dua atau lebih substitusi yang sma, misalny dua
gugus etil atau tiga gugus t-butil, nama awalannya hanya dipakai sekali. Nomor tempat
dari substitusi yang sama dijadikan satu
awalan lain. Contoh:
Untuk
menulis rumus suatu struktur dari nma sistematikanya, mulai dengan rantai induk
lalu:
1.
Gambarkan
rantai lurusnya dan beri nomor
2.
Tambahkan
gugus awalan pada rantai induk
3.
Isi
atom hydrogen yang hilang
B. Isomer Struktur
Isomer struktur adalah senyawa yang
mempunyai rumus molekul yang sama, tetpi berbeda dalam strukturnya (atom-atom
terikat dalam jenis yang berbeda). Etanol dan eter misalnya, memiliki struktur
isomer. Senyawa-senyawa ini memilik rumus molekul yang sama (C2H6O),
tetapi mereka memiliki struktur yang berbeda.

Makin banyak jumlah atom dalam
molekul, kemungkinan adanya sejumlah isomer makin besar. rumus molekul C5H12
menggambarkan tiga struktur isomer dan rumus C10H22
menggambarkan 75 struktur isomer yang berbeda.
C. Isomer Pada Alkana
Isomer adalah peristiwa di mana suatu
senyawa karbon mempunyai rumus molekul sama tetapi struktur berbeda.
.bmp)